Гидроксид кальция, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксид кальция. Свойства и меры предосторожности
Оксид кальция — неорганическое соединение с формулой CaO. В литературе также можно встретить такие его названия, как негашеная известь, окись кальция, жженая известь, кирабит, «кипелка».
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.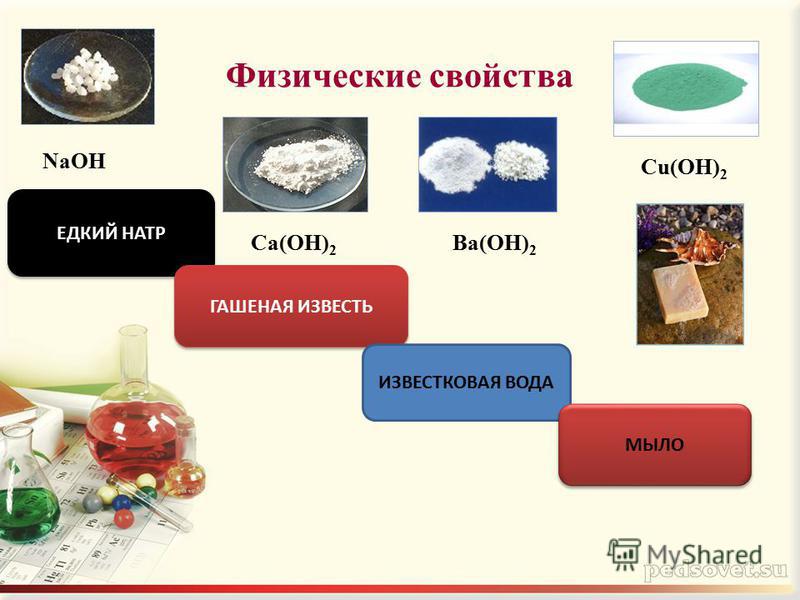
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
| Полнолицевая маска «ЗМ» серии 6900 | Кальций окись «ч» | Перчатки «Неотоп» химостойкие (Ansell) (9,5-10) |
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
При работе с оксидом кальция (как на производствах, так и в быту) следует использовать защитную одежду; респиратор; очки; перчатки, стойкие к щелочам. На предприятиях обязательно контролируют ПДК реактива в воздухе. Рабочее место должно располагаться в помещении с общей принудительной вентиляцией. Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Хранят реактив в герметичной упаковке (многослойные ламинированные бумажные мешки), на сухих крытых складах с хорошей механической вентиляцией, при комнатной температуре. Реактив несовместим с водой, фтором, сильными кислотами.
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
Гидроксид кальция – структура, свойства и использование Ca(OH)2
Гидроксид кальция, обычно называемый гашеной известью, описывается химической формулой Ca(OH) 2 . Это неорганическое соединение, которое в твердом состоянии имеет белый порошкообразный вид. Однако Ca(OH) 2 в кристаллической форме имеет бесцветный вид.
Это неорганическое соединение, которое в твердом состоянии имеет белый порошкообразный вид. Однако Ca(OH) 2 в кристаллической форме имеет бесцветный вид.
Альтернативные названия этого соединения включают гашеную известь, гашеную известь, травильную известь и едкую известь. Как правило, гидроксид кальция получают путем смешивания воды и оксида кальция (также известного как негашеная известь).
Химическая реакция между гидроксидом натрия и хлоридом кальция, растворенным в воде (водный раствор CaCl 2 ), также дает это соединение. Структура молекулы Ca(OH) 2 показана ниже.
Молекулы гидроксида кальция удерживаются вместе за счет ионных связей между ионом кальция (Ca 2+ ) и двумя ионами гидроксида (OH – ). Незащищенное воздействие этого соединения может оказаться опасным для человека, приводя к раздражению кожи и химическим ожогам. Воздействие концентрированного Ca(OH) 2 может привести к повреждению легких и даже к слепоте.
Содержание
- Свойства гидроксида кальция
- Физические свойства
- Химические свойства
- Использование гидроксида кальция
- Часто задаваемые вопросы
Свойства гидроксида кальция
Некоторые важные свойства гидроксида кальция приведены в таблице ниже.
| Химическая формула | Са(ОН) 2 |
| Название ИЮПАК | Гидроксид кальция |
| Молекулярная масса/Молярная масса | 74,093 г на моль |
| Плотность | 2,211 грамма на кубический сантиметр |
| Внешний вид | Белый порошок или бесцветные кристаллы |
| Точка плавления | 853 К |
Физические свойства
- Са(ОН) 2 имеет гексагональную кристаллическую структуру.
- Плохо растворяется в воде, и его растворимость снижается с повышением температуры.
 Например, его растворимость при 0 o C составляет 1,89 г/л, а его растворимость составляет 1,73 г/л при 20 o C
Например, его растворимость при 0 o C составляет 1,89 г/л, а его растворимость составляет 1,73 г/л при 20 o C - При температурах, приближающихся к точке плавления, это соединение теряет воду и разлагается.
- Произведение растворимости (K sp ) гидроксида кальция составляет 5,5 * 10 -6 .
Химические свойства
- Ca(OH) 2 хорошо растворим в глицерине и кислотах, но мало растворим в воде. При растворении в воде до точки насыщения он дает раствор, который действует как умеренное основание (так называемый известковый раствор).
- Известковая вода реагирует с кислотами и образует соли.
- Насыщенный раствор гидроксида кальция в воде также реагирует и растворяет металлы, такие как алюминий.
- Реагирует с диоксидом углерода с образованием карбоната кальция (CaCO 3 ). Эту реакцию обычно называют карбонизацией.
Применение гидроксида кальция
- В процессе очистки сточных вод гидроксид кальция используется в качестве осветлителя или флокулянта.

- Ca(OH) 2 используется в бумажной промышленности во время крафт-процесса переработки древесины в древесную массу.
- Это очень важное соединение при получении аммиака.
- Это соединение также используется в качестве модификатора pH из-за его основности.
- Засолка огурцов обычно производится с помощью Ca(OH) 2
- В производстве многих пластмасс используется гидроксид кальция в качестве ингредиента.
- Он также используется в пестицидах, средствах по уходу за волосами и производстве эбонита.
- При лечении корневых каналов это соединение используется для заполнения полостей в зубах человека.
- Сахарная свекла и сахарный тростник перерабатываются путем карбонизации с использованием Ca(OH) 2 .
- Гидроксид кальция используется в кожевенной промышленности для отделения меха/волос от шкуры животных.
Часто задаваемые вопросы
Каковы виды использования гидроксида кальция?
Гидроксид кальция представляет собой белый порошок без характерного запаха. Он используется в промышленных условиях, таких как обработка отходов, производство бумаги, строительство и переработка продуктов питания. Есть также несколько медицинских и стоматологических применений этого соединения. Например, пломбы, используемые для лечения корневых каналов, часто содержат гидроксид кальция.
Он используется в промышленных условиях, таких как обработка отходов, производство бумаги, строительство и переработка продуктов питания. Есть также несколько медицинских и стоматологических применений этого соединения. Например, пломбы, используемые для лечения корневых каналов, часто содержат гидроксид кальция.
Является ли гидроксид кальция кислотным или основным?
Гидроксид кальция, также известный как гашеная известь (с химической формулой Ca(OH)2), является источником гидроксид-ионов при растворении в водных растворах. Следовательно, это соединение является основанием. В результате диссоциации электролита это соединение высвобождает ионы ОН-.
Как можно получить гидроксид кальция?
Гидроксид кальция образуется при воздействии воды на оксид кальция, также называемый гашеной известью, Ca(OH)2. Небольшая его часть растворяется при соединении с водой, образуя раствор, известный как известковая вода, а оставшаяся часть остается в виде суспензии, называемой известковым молоком.
Является ли гидроксид кальция ионным или ковалентным?
Гидроксид кальция является ионным.
Таким образом, структура и важные свойства гидроксида кальция обсуждаются наряду с некоторыми его применениями. Чтобы узнать больше об этом соединении и других соединениях кальция, таких как CaCO 3 , зарегистрируйтесь в BYJU’S и загрузите мобильное приложение на свой смартфон.
Гашеная известь – состав, получение, свойства и применение
Перейти к содержимому
Структура гидроксида кальция
- Гидроксид кальция представляет собой неорганическое соединение с химической формулой Ca(OH)2. Это белое твердое вещество, растворимое в воде. Он образуется при смешивании оксида кальция (извести) с водой.
- Гашеная известь представляет собой соединение оксида кальция и воды. При смешивании извести с водой происходит химическая реакция, называемая гашением. Оксид кальция соединяется с водой, образуя гидроксид кальция. Гашеная известь используется во многих отраслях промышленности и строительства.

- Гашеная известь представляет собой белый порошок, который используется во многих отраслях промышленности и строительства. Его получают реакцией оксида кальция и воды. При смешивании извести с водой происходит химическая реакция, называемая гашением. Оксид кальция соединяется с водой, образуя гидроксид кальция. Гидроксид кальция представляет собой белый порошок, очень щелочной. Он используется во многих промышленных процессах для нейтрализации кислот. Он также используется в качестве строительного материала.
- Гашеная известь используется во многих промышленных процессах для нейтрализации кислот. Одним из распространенных применений является производство бумаги. Древесная масса, используемая в производстве бумаги, является кислой. Гидроксид кальция нейтрализует кислоту и помогает производить прочную и долговечную бумагу.
- Гидроксид кальция также используется в качестве строительного материала. Используется для приготовления раствора и штукатурки. Раствор представляет собой смесь извести, песка и воды, которая используется для скрепления кирпичей или камней.
 Штукатурка представляет собой смесь извести, воды и песка, которая используется для покрытия стен и потолков. Гидроксид кальция помогает сделать раствор и штукатурку прочными и долговечными.
Штукатурка представляет собой смесь извести, воды и песка, которая используется для покрытия стен и потолков. Гидроксид кальция помогает сделать раствор и штукатурку прочными и долговечными.
Получение гидроксида кальция
Гидроксид кальция представляет собой белое твердое вещество, которое обычно используется при получении других соединений. Его можно получить реакцией оксида кальция с водой:
Заполните форму для экспертного академического руководства!
Класс
— Класс 6 Класс 7 Класс 8 Класс 9 Класс 10 Класс 11 Класс 12
Целевой экзамен
JEENEETCBSE
+91
Предпочтительный временной интервал для звонка 1:0012 pm1 pm2 pm3 pm4 pm5 pm6 pm7 pm8 pm9 10 вечера
Укажите, что вас интересует.0002 Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
CaO (т) + h3O (ж) → Ca(OH)2 (т)
Свойства гидроксида кальция
- Гидроксид кальция представляет собой белое кристаллическое твердое вещество, растворимое в воде.


 Например, его растворимость при 0 o C составляет 1,89 г/л, а его растворимость составляет 1,73 г/л при 20 o C
Например, его растворимость при 0 o C составляет 1,89 г/л, а его растворимость составляет 1,73 г/л при 20 o C 

 Штукатурка представляет собой смесь извести, воды и песка, которая используется для покрытия стен и потолков. Гидроксид кальция помогает сделать раствор и штукатурку прочными и долговечными.
Штукатурка представляет собой смесь извести, воды и песка, которая используется для покрытия стен и потолков. Гидроксид кальция помогает сделать раствор и штукатурку прочными и долговечными.